本文信息综合自药物简讯、21世纪经济报道、和讯网、每日经济新闻、东方财富网、新京报
7月4日晚间,兴齐眼药(300573)发布公告,硫酸阿托品滴眼液(SQ-761)根据《中华人民共和国药品管理法》及有关规定,经审查,本品不符合药品注册的有关要求,不批准本次注册申请。
理由如下:本品参照台湾上市0.01%硫酸阿托品滴眼液进行仿制研发,但经过参比制剂遴选专家会议讨论认为,台湾麦迪森医药股份有限公司生产的0.01%硫酸阿托品滴眼液安全有效性不充分,故由台湾麦迪森医药股份有限公司生产的0.01%硫酸阿托品滴眼液不能列为参比制剂。根据第一百五十四条第(四)项的规定,不予批准。
公司于2018年8月首次向国家药监局递交了上述产品的注册申请并获得受理。该产品申报的临床适应症为:散瞳及睫状肌麻痹。注册分类为化学药品3类(SQ-761)。
有市场人士分析,兴齐眼药此次被否的“硫酸阿托品滴眼液”为化学3类药,属于仿制药,而此前公司自主研发的2.4类的硫酸阿托品滴眼液已经获得临床试验通知书,此次仿制药被否其实对公司而言是利好。
今年1月,兴齐眼药曾发布公告,公司注册分类为“化学药品2.4类”的新药硫酸阿托品滴眼液(SQ-729)获得国家药品监督管理局签发的药品临床试验通知书,上述新药的临床试验申请已于2018年10月26日获得国家药品监督管理局的受理。
据悉,该药主要用于延缓儿童近视进展。而目前国内尚无延缓儿童近视进展的硫酸阿托品滴眼液产品上市。
这款2.4类硫酸阿托品滴眼液(SQ-729)临床试验获批,是兴齐眼药股价暴涨的重要“推手”。
有机构指出,国内按照2.4类化药注册,首家获批后拥有3年的市场监测期,儿童用药可能延长至5年。凭借3-5年的市场独占期,首家获批产品很可能取得未来市场的50%的市占率,峰值销售规模或将达数十亿元。
公司策略?
有股吧投资者指出,“兴齐眼药被否的化药新3类属于仿制药,如果仿制药通过,别的公司也可以去找国外机构合作花点钱来投入生产,然后竞争加大兴齐眼药即便早开发最终也会被挤压。”
“而如果仿制药被否,则说明国内0.01%浓度的阿托品只能自己临床研发不能再仿制,而兴齐眼药有3年保护期,大概率会获得通过,只要积累足够的样本和效果,那么兴齐眼药就具有专利权,可以卖专利也可以不卖一家独大。”

甚至有投资者认为,兴齐眼药申报3类硫酸阿托品滴眼液是公司的竞争策略,而未被获批早就在上市公司意料之内。
今年1月,曾有投资者在调研时提问兴齐药业管理层“公司申报的3类和2.4类硫酸阿托品滴眼液的具体临床方案和临床试验进展如何?为什么同一产品申报两个不同的适应症?”
兴齐眼药回应称,“一个产品报两个适应症的原因是出于公司市场策略方面的考虑。”

在当晚的公告中,兴齐眼药也指出,公司前期申报的注册分类为2.4类的硫酸阿托品滴眼液(SQ-729)已经获得临床试验通知书,国家药监局同意开展延缓儿童近视进展的临床试验。目前,相关工作正在进行中。公司本次申报的3类硫酸阿托品滴眼液(SQ-761)未予批准,不会对公司当期业绩产生重大影响。
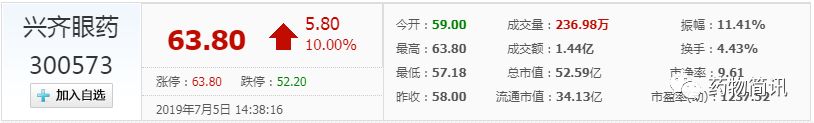
看似一则简单的上市未批准的公告,其实背后蕴藏很多玄机。首先,兴齐眼药股价在7月5日涨停,市值达到52亿,中国韭菜还是比较有耐心的。其次,公告3类临床试验用的参比制剂有问题,这个临床试验批件是先拿到的,但是并未查到临床试验的信息,反而上市申请事项显示为:减或者免临床研究。查询上市公司信息发现3类药是按照新的注册管理办法直接报产,并未拿到过临床批件。2.4类是申请临床试验,前后3个月时间差让人觉得不可思议。



据悉,刘总16年就盯上阿托品并且获得了新加坡国立眼科独家授权,拿到了10年临床研究数据,在此基础上2019年1月份获批了院内制剂,并且拿到了临床批件开始三期临床研究,获批后可获得3年保护期,获批前可以通过省内、跨省调剂提前实现阿托品销售。如果真是这样为何不直接用新加坡国立眼科的原研做参比制剂?(今年6月24家机构密集调研兴齐)
兴齐眼科医院制剂(低浓度阿托品)与新加坡国立眼科中心产品的区别?
按合作协议,兴齐眼科医院院内制剂低浓度阿托品滴眼液在开发时参考了新加坡国立眼科中心低浓度阿托品产品的一些标准。另外,我们的院内制剂为单剂量包装,不含防腐剂,长期使用更安全。

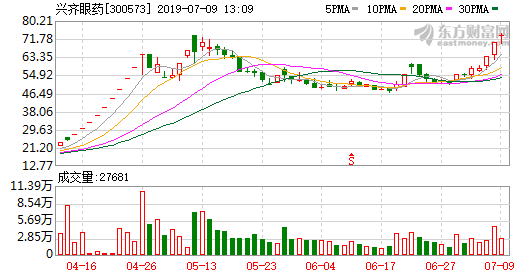
兴齐眼药主要产品为眼科处方药,在今年4月曾经14天13个涨停,其主要的上涨区间为4月10日至5月10日,在短短一个月间,股价上涨了233.50%。而就在4月17日,兴齐眼药连发了两个药品注册批件公告,盐酸奥洛他定滴眼液和溶菌酶滴眼液均获得了新药批件。前者主要用于治疗过敏性结膜炎的体征和症状,同时该产品为国家医保目录乙类产品;后者主要用于治疗慢性结膜炎。
有市场人士认为,其连续暴涨一个重要的原因就是公司有新药在申请审批,这使得投资者对其经营业绩充满预期。
其中,在4月8日,兴齐眼药公告,公司提交的溶菌酶滴眼液注册申请在国家食药监局网站的办理状态变更为“审批完毕-待制证”,这表示国家药监局行政受理服务中心正在制作批件,公司尚未取得正式药品批件。4月10日,兴齐眼药公告,公司提交的盐酸奥洛他定滴眼液注册申请在国家食药监局网站的办理状态变更为“审批完毕-待制证”。4月30日,兴齐眼药公告,收到国家药品监督管理局下发的左氧氟沙星滴眼液注册受理通知书,该产品可用于治疗眼睑炎、睑腺炎等。
有观点认为,真正吸引市场的是兴齐眼药在一季报中提到的“硫酸阿托品滴眼液”的进展,市场多家机构对于硫酸阿托品滴眼液高度关注。该眼药在海外被认为可用于延缓儿童近视进展,但国内尚无类似产品获批上市。
兴齐眼药年报显示,2018年,该公司实现营收4.31亿元,同比增长19.78%;实现净利1365.87万元,同比下降65.37%。其中,凝胶剂/眼膏剂实现营收2.6亿元,毛利率达82.63%;滴眼剂实现营收1.54亿元,毛利率达57.88%。
在兴齐眼药的年报和季报等公开披露资料中,目前还没有看到硫酸阿托品滴眼液的任何具体营收数据与研发成本数据。

图片来源:摄图网
7月5日上午,兴齐眼药证券事务代表接受新京报记者采访时表示,暂时还不清楚公司是否会再次提交关于3类硫酸阿托品滴眼液的注册申请,公司申报的2.4类的硫酸阿托品滴眼液已经获得临床试验通知书,两个产品的API(活性医药物成分)、浓度等均相同,因所申报的适应证有所区别,故申报类别不同,后续将继续开展2.4类的硫酸阿托品滴眼液的临床试验。
| 图片来源:药物简讯、21世纪经济报道、每日经济新闻、东方财富网
| 数据来源:药物简讯、21世纪经济报道、每日经济新闻、东方财富网、新京报
| 本文由中国眼科网(www.yanke360.com)综合整理,整理不易,转载请注明出处

更多新闻请点击:





